Získávání energeticky významných prvků z oceánů (I): Lithium
Oceány pokrývají dvě třetiny naší planety a skýtají v sobě obrovské množství energie a energeticky významných prvků. Jedním z nich je lithium, po kterém roste v současné době na světových trzích poptávka téměř exponenciálně. Je to způsobeno jeho využitím v moderních trendech průmyslu.
Úvodem
Lithium zdánlivě nepatří mezi obnovitelné zdroje a úspory energie, ale bez jeho využití si budoucnost "skladování" energie neumíme představit. Poptávka po něm roste na světových trzích v současné době téměř exponenciálně. Je to způsobeno jeho úspěšným využitím v moderních trendech průmyslu, ať už je to jeho aplikace v nabíjecích bateriích všudypřítomných mobilních telefonů a přenosných počítačů anebo jako paliva pro jadernou fúzi. Nynější světové zásoby ve formě nerostných surovin činí zhruba 14 miliónů tun, což dokáže za stávajících podmínek uspokojit současnou potřebu lidstva. Mořská voda, která obsahuje 230 miliard tun lithia, je takřka nevyčerpatelným alternativním zdrojem tohoto prvku.
První zmínku o lithiu nalezneme v roce 1800, kdy na mineralogické expedici na ostrově Uto (blízko nynějšího švédského hlavního města Stockholmu) nalezl brazilský vědec Bonifacio dva neobvyklé kameny v odpadním materiálu v dole na těžbu a zpracování železa. Pojmenoval je spodumen a pedalit. Jeho objev upadl na 17 let v zapomnění, až opět na další mineralogické expedici na ostrově Uto byly nalezeny úlomky pedalitu a rozeslány mezi tehdejší elitní vědce. Švédskému vědci Jacobu Berzeliovi se nedařilo identifikovat okolo 4 % petalitu a správně předpokládal, že se v něm skrývá doposud neznámý prvek. Dal mu jméno lithium (z řeckého lithos - kámen). Prvně jej dokázal izolovat v roce 1818 anglický chemik Davy a ve větším měřítku se jej podařilo izolovat v roce 1853 Bunsenovi.
 spodumen |
 pedalit |
Izolace lithia
Lithium se v přírodě nenachází volně, ale buďto v minerálech (většina hlubinných vyvřelin) anebo v minerálních vodách (v koncentracích i přes 200 ppm). V mořích jeho koncentrace kolísá mezi 0,1 a 0,2 ppm.
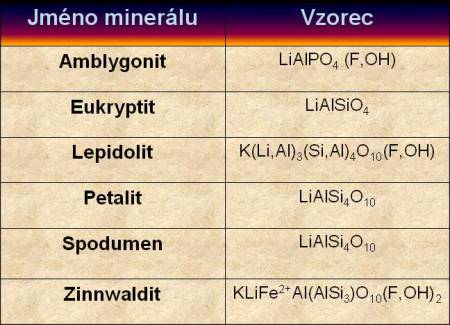
Ze zhruba stodeseti minerálů, které obsahují lithium, se nejběžněji vyskytuje spodumen, lepidolit, petalit a amblygonit. Souhrn nejvýznamnějších minerálů obsahujících lithium je v níže uvedené tabulce. V současné době ovšem převládá ekonomicky výhodnější trend získávání lithia z podzemních minerálních vod. Celkově lze říci, že zhruba 2/3 lithia z pozemních zdrojů je obsaženo v minerálních vodách a zhruba 1/3 lithia se získává z minerálů. Z minerálů zhruba 95 % připadá na spodumen a 3 % na petalit.
Lithium lze z minerálů získávat několika způsoby. Kyselý způsob spočívá v zahřátí rudy v peci na teplotu zhruba 1100 °C. Po pražení je ruda smíšena s kyselinou sírovou a nadále zahřívána při teplotě okolo 250 °C. Poté je extrahována vodou do roztoku ve formě Li2SO4. Li2CO3 se poté získá úpravou přidáním uhličitanu sodného, úpravou pH, dočištěním a odpařením. Uhličitan se poté převede na LiCl reakcí s HCl. Bazický způsob spočívá v rozdrcení rudy a jejím následném pražení s vápencem při 900 °C. Výsledná směs je rozmělněna a vodou je z ní extrahován LiOH, ze kterého je LiCl získán opět reakcí s HCl.
Z minerálních vod se lithium může získat např. zakoncentrováním a vysrážením ve formě Li2NaPO4. Z něj je vyroben uhličitan litný, který je pak finálním produktem.
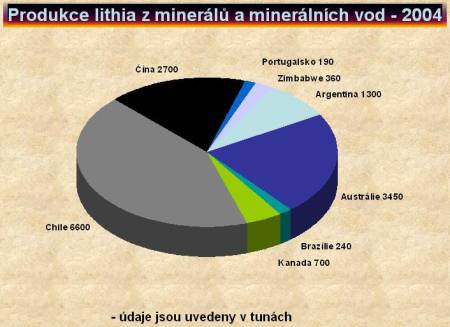
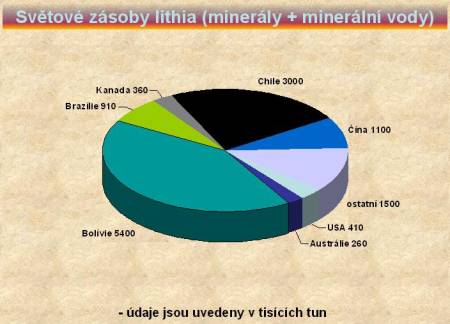
Světovému trhu dominuje Chile a Austrálie, jak je patrné i z koláčového grafu. Obě země získávají lithium ve formě chloridu nebo uhličitanu litného z minerálních vod. Nejvíce nerostů obsahujících lithium se nalézá v Bolívii, kde zatím chybí dostupná a levná technologie pro jejich těžbu.
Aplikace lithia a jeho nejvýznamnější sloučeniny
Ze široké škály aplikací lithia se sluší vyzdvihnout využití v nabíjecích bateriích pro mobilní telefony a přenosné počítače. S boomem výroby těchto produktů zákonitě vzrůstá i poptávka po lithiu. Lithiové baterie lze úspěšně využít při designu bezemisních aut, i když jejich praktické uplatnění ve větším měřítku prozatím ztroskotává na výdrži baterie. V budoucnu lze očekávat nárůst poptávky po lithiu zejména v jaderném průmyslu, kde bude sloužit jako zdroj pro výrobu tritia v termonukleárních fúzních reaktorech. (pozn. redakce: Fúzní reaktor lze považovat za naprosto čistý zdroj energie, jediným odpadem bude neškodné helium). Lithium skýtá uplatnění i v leteckém průmyslu, kde jsou žádané jeho lehké a odolné slitiny s hliníkem. Čistý prvek se používá na odstranění nežádoucích plynů při výrobě barevných kovů. Dále se používá na výrobu skelných vláken anebo jako náhrada za prvky škodící životnímu prostředí, jako je třeba fluor.
Ze sloučenin lithia je průmyslově nejvýznamnější asi stearát, který slouží jako zahušťovadlo při výrobě lubrikačních olejů. Uhličitan litný (Li2CO3) má využití v keramice, lékařství, jako tavidlo anebo katalyzátor. Hydroxid litný (LiOH) se používá do baterií a na tvrobu litných solí, olejů a mýdel. Chlorid litný (LiCl) nalézá uplatnění v klimatizačních zařízeních a jako náplň do baterií. Fluorid litný (LiF) má využití v keramice a optice. Bromid litný (LiBr) je adsorbent v chladicích zařízeních, atd., atd.
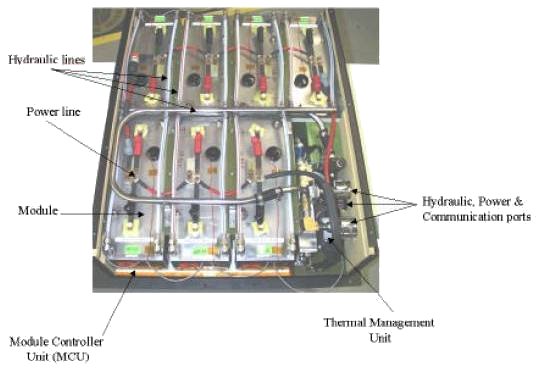
LMP baterie do bezemisních aut
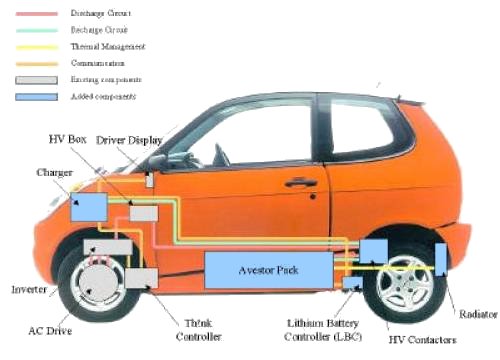
Schematický nákres bezemisního vozidla
Pro efektivní získávání lithia z moře je nutný selektivní adsorbent
Ačkoliv soudobé nároky na spotřebu lithia stávající produkce pokryje, je vhodné nalézt i alternativní zdroj a příp. porovnat cenu získaného prvku pomocí různých technologií. Mořská voda je vhodným zdrojem lithia, protože ho obsahuje téměř nevyčerpatelnou zásobu - 230 miliard tun. Na vědeckém poli se o izolaci lithia z mořské vody snaží především Japonsko a Jižní Korea. V nedávných letech byly testovány různé technologie provádějící izolaci lithia z mořské vody. Byla snaha lithium vysrážet, získat extrakcí anebo adsorbovat. Jako nejvhodnější a nejúčinnější metoda se ukázala adsorpce.
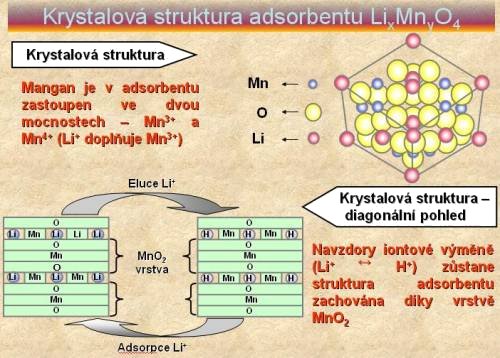
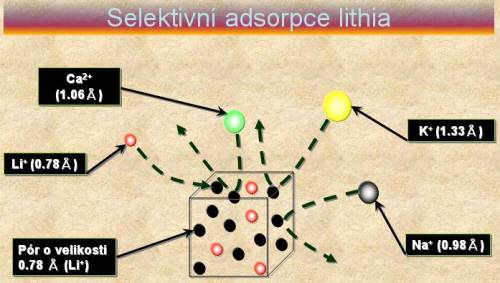
Adsorpční mechanismus využívá i poloprovozní jednotka, která byla postavena v Oceánografickém institutu v Imari. Jednotka je součástí systému, který získává energii z oceánu a jako podružné projekty jsou vedle získávání lithia např. získávání pitné a užitkové vody anebo získávání vodíku. Hlavním problémem při získávání lithia z moře je vysoká koncentrace sodíku (okolo 10.000 ppm), zatímco koncentrace lithia se pohybuje mezi 0,1-0,2 ppm, proto je snaha o získání selektivního adsorbentu. Z nich se jako nejvhodnější jeví adsorbenty na bázi MnO2, kvůli vysoké sorpční kapacitě v bazické oblasti (pH mořské vody se pohybuje okolo 8,1). Selektivní adsorbent se vyrábí společným spékáním Mn3O4 a hydratovaného LiOH při 500 °C. Iontovou výměnou Li+ za H+ (ve formě 1M HCl) je docíleno struktury adsorbentu (spinelová struktura λ-MnO2). Jeho granulace je poté provedena pomocí chitinového roztoku ve vysokorychlostním granulátoru.
Poloprovozní jednotka na získávání lithia
Schematický nákres poloprovozní jednotky je znázorněn níže. Do systému je čerpána mořská voda s konstantním přítokem 200 l/h. Okolo 60 kg adsorbentu je naplněno v kolonách o objemu 1 m3. Po ukončení adsorpční fáze a promytí adsorbentu nastává eluce 0,2 M HCl. Produkt ve formě LiCl je získáván v rotační odparce a kyselina chlorovodíková je recyklována zpět vakuovou destilací. V prvním třicetidenním cyklu bylo získáno okolo 160 g směsi, z níž čistý výtěžek (ve formě LiCl) činil okolo dvaceti procent. Finální produkt obsahoval vedle očekávaných nežádoucích příměsí (sodné, vápenaté a draselné soli) i nečistoty organického rázu, vzniklé působením agresivní mořské vody na organický adsorbent. Současný výzkum je směřován k testování odolnosti organického adsorbentu a k testování anorganických selektivních adsorbentů, u kterých se používá pro granulaci, namísto chitinového roztoku, roztok SiO2. Anorganické adsorbenty sice na základě laboratorních pokusů vykazují nižší adsorpční schopnosti, ale na druhou stranu prokazují zvýšenou odolnost oproti mořské vodě. Hlavním cílem poloprovozní jednotky na selektivní získávání lithia z mořské vody je ovšem ekonomická analýza a porovnání investic na stavbu a na vlastní provoz s ostatními soudobými technologiemi na získávání lithia z minerálů, resp. minerálních vod. S pomocí speciálního software bude sestaven dynamický model systému, schopný spočítat náklady vynaložené na získání lithia z mořské vody.
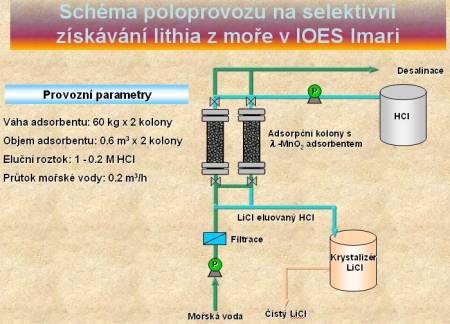

Celkový pohled na poloprovozní jednotku na získávání lithia z mořské vody (v popředí tanky na HCl)
 Adsorpcni kolony a filtrační jednotka na mořskou vodu |
 Odparka na získávání LiCl |
Seznam použité a citované literatury
- A.H. Hamzaoui, A. M'Nif, H. Hammi and R. Rokbani, Contribution to the Lithium Recovery From Brine, Desalination, 158, pp. 221-224 (2003).
- R. Chitrakar, H. Kanoh, Y. Miyai, and K. Ooi: Recovery of Lithium from Seawater Using Manganese Oxide Adsorbent (H1.6Mn1.6O4) Derived from Li1.6Mn1.6O4, Ind. Eng. Chem. Res., 40, pp. 2054-2058 (2001).
- E. Kunugita, J.H. Kim, and I. Komasawa: Process for Recovery and Purification of Lithium from Dilute Sources, Kagaku Kogaku Ronbunshu, 16, pp. 1045-1052 (1990).
- K. Ooi, Y. Miyai, and J. Sakakihara: Mechanism of Li+ Insertion in Spinel-Type Manganese Oxide Redox and Ion-Exchange Reactions, Langmuir, 7, pp. 1167-1171 (1991)
- S. Tsuchiya, Y. Nakatani, R. Ibrahim and S. Ogawa: Highly Efferent Separation Lithium Chloride from Seawater, J. Am. Chem. Soc., 124, pp. 4936-4937 (2002).
- Umeno, Y. Miyai, N. Takagi, R. Chitrakar, K. Sakane, and K. Ooi: Preparation Adsorbent Properties of Membrane-Type Adsorbents for Lithium Recovery from Seawater, Ind. Eng. Chem. Res., 41, pp. 4288-4287, (2002).
- K. Tsuchiya and H. Kawamura: Trial fabrication of tritium breeders for fusion blanket with lithium recovered from seawater, Fusion Engineering and Design, 39-40, pp. 737-744 (1998).
- K. Yoshizuka, K. Fukui and K. Inoue: Selective Recovery of Lithium From Seawater Using a Novel MnO2 Type Adsorbent, Ars Separatoria Acta, 1, pp. 79 - 86, (2002).
- M. Holba, A. Kitajou, T. Suzuki, S. Nishihama, K. Yoshizuka, Y. Ikegami, M. Monde, Performance of benchmark plant of lithium recovery from seawater using a novel λ-MnO2 adsorbent, 16th International Congress of Chemical and Process Engineering CHISA 2004, pp. 864 - 865, (2004).
- www.avestor.com/rtecontent/document/evs18.pdf
- U.S Geological Survey, Mineral Commodity Summaries 2004
- webmineral.com/chem/Chem-Li.shtml